文章目录[隐藏]
通常所说的Th1、Th2、Th17是指在各种生理与病理条件下有能力分化为Th1、Th2、Th17的辅助性T细胞(严格意义上是Th0)。静息状态(未受任何刺激,如人的正常生理状态)下,Th0分化为Th1、Th2、Th17的能力非常弱;当受到外界因素(如刺激素、病原体等)刺激,Th0即会向Th1、Th2、Th17等Th细胞分化,此时,通过检测分泌的细胞因子(如IFN-γ、IL-4、IL-17等)实现对各类Th细胞的检测。正常情况下机体中Th1、Th2和Th17处于相对平衡的状态,当这种平衡打破时可能引起多种疾病的发生,如肿瘤、自身免疫性疾病等。
细胞因子及功能
Th17:分泌IL-17A、IL-17F、IL-21等细胞因子,主要介导自体免疫反应,增强对细菌和真菌感染的防御。
金沙6165总站线路检测生物可提供小鼠/人的Th1、Th2、Th17和Treg检测试剂盒。下面以小鼠Th1/Th2检测为例。
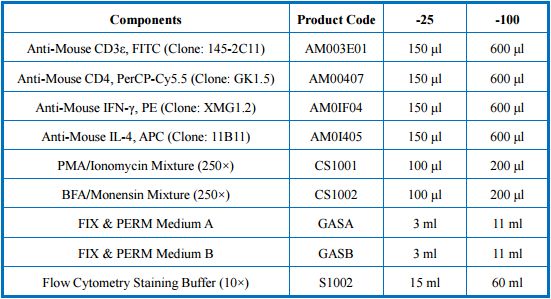
小鼠Th1/Th2检测试剂盒组分
样本制备
1a. 对于肝素抗凝血,取125 μl抗凝血至流式管中,加入125 μl不含血清的培养基和1μl PMA/Ionomycin Mixture (250×)和1 μl BFA/Monensin Mixture (250×)。取125 μl抗凝血和125 μl不含血清的培养基,作为对照。混匀,37℃孵育4-6小时,每隔1-2小时取出震荡混匀;
1b. 对于使用其它抗凝剂(如EDTA、枸橼酸钠)抗凝血,用淋巴细胞分离液分离外周血单个核细胞(PBMCs)。用含10%胎牛血清的培养基重悬沉淀,使细胞浓度为1×107/ml。取250μl PBMCs至流式管中,加入1 μl PMA/Ionomycin Mixture (250×) 和1 μl BFA/Monensin Mixture (250×)。以只含PBMCs的样本作为对照。混匀,37℃孵育4-6小时,每隔1-2小时取出震荡混匀;
1c. 对于脾脏组织,使用适当的方法制备成单细胞悬液,并去除团块。
(可选)使用淋巴细胞分离液分离制备脾单个核细胞。
用含10%胎牛血清的培养基重悬沉淀,使细胞浓度为1×107/ml。取250 μl细胞悬液至流式管中,加入1 μl PMA/Ionomycin Mixture (250×)和1 μl BFA/Monensin Mixture (250×)。以只含细胞悬液的样本作为对照。混匀,37℃孵育4-6小时,每隔1-2小时取出震荡混匀;
2.从样本管和对照管中取100 μl细胞悬液至新的流式管中,加入5 μl Anti-Mouse CD3ε, FITC 和5 μl Anti-Mouse CD4, PerCP-Cy5.5。震荡混匀,室温避光孵育15分钟;
3.每管加入100 μl FIX & PERM Medium A,震荡混匀,室温避光孵育15分钟;
4.用蒸馏水将10× Flow Cytometry Staining Buffer稀释为1×,每管加入2 ml预冷1×Flow Cytometry Staining Buffer,300 x g离心5分钟,弃上清;
注:液体尽量倒干净,不要有残留;
5.每管加入100 μl FIX & PERM Medium B、5 μl Anti-Mouse IFN-γ, PE和5 μl Anti-Mouse IL-4, APC。震荡混匀,室温避光孵育15分钟;
6.每管加入2 ml 1× Flow Cytometry Staining Buffer,300 x g离心5分钟,弃上清;
7.每管加入500 μl 1× Flow Cytometry Staining Buffer重悬,上机检测;或者加入500 μl 1-4%多聚甲醛重悬,2-8℃避光,于24小时内检测。
上机检测
2. 正确设门以得到Th1和Th2细胞在CD3+CD4+辅助T细胞中的比例。
注:至少获取20000-30000 CD3+CD4+ T细胞。对于某一细胞因子,因品系和个体差异,分泌该细胞因子的细胞比例差异很大。为了进行统计学差异比较,请获取足够多的细胞样本。需要注意的是,PMA/Ionomycin刺激的细胞中,分泌IL-4的细胞非常低,甚至可忽略。此时,可考虑IL-4的极化培养。
结果示例
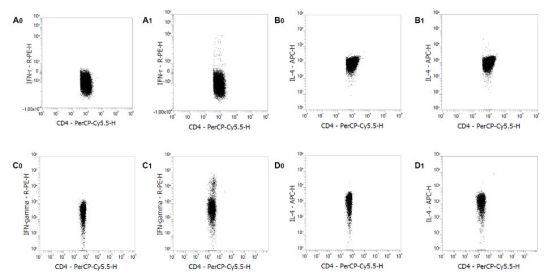
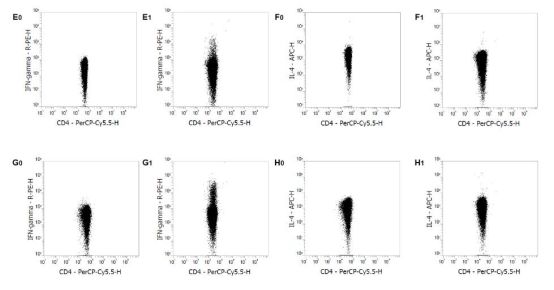
使用Mouse Th1/Th2 Staining Kit进行流式检测。正常ICR小鼠的静息肝素抗凝血(A0, B0)、EDTA抗凝血来源的PBMCs (C0, D0)、脾细胞(E0, F0)和脾单个核细胞(G0, H0)染色IFN-γ和IL-4。正常ICR小鼠的PMA/Ionomycin刺激的肝素抗凝血(A1, B1)、EDTA抗凝血来源的PBMCs (C1, D1)、脾细胞(E1, F1)和脾单个核细胞(G1, H1)染色IFN-γ和IL-4。对CD3+/CD4+细胞进行设门分析。
相关产品

相关产品部分引用文献
3.Chen X, Fang M, Hong J, Guo Y. Longitudinal Variations in Th and Treg Cells Before and After Percutaneous Coronary Intervention, and Their Intercorrelations and Prognostic Value in Acute SyndromePatients. Inflammation. Published online June 14, 2024.
4.Tan H, Hu J, Zuo W, et al. Activation of the High Mobility Group Box 1/Receptor for Advanced Glycation Endproducts /NOD-like Receptor Family Pyrin Domain-Containing 3 Axis Under Chronic Intermittent Hypoxia Induction Promotes the Progression of Atherosclerosis in ApoE-/- Mice. J Am Heart Assoc. 2023;12(8):e024397.







